>>關于醫療器械唯一標識數據庫
醫療器械唯一標識數據庫是由國家藥品監督管理局統籌規劃建立,內容主要包含醫療器械產品標識及相關信息。醫療器械注冊人/備案人應當按照相關標準或者規范要求上傳、維護和更新唯一標識數據庫中的相關數據,并對數據真實性、準確性、完整性負責。醫療器械唯一標識數據庫實現公開和共享,為醫療器械行業和相關部門的應用提供數據基礎。
>>>系統操作指南
1、編寫目的
本用戶手冊指導醫療器械唯一標識管理信息系統用戶了解系統功能、進行系統操作。
2、適用對象
本用戶手冊適用于使用此系統的所有注冊人/備案人、發碼機構用戶操作人員。
3、注冊人/備案人申報方式
醫療器械唯一標識管理信息系統為注冊人/備案人提供三種數據申報途徑。
網頁填報:注冊人/備案人登錄系統后,直接在網頁填報提交。
批量導入:注冊人/備案人登錄系統后,下載系統提供的數據模板,注冊人/備案人按照要求準備好數據,再通過數據模版批量導入功能批量導入數據,模板請參考:《醫療器械唯一標識信息系統數據導入模板v2-20200903》
申報接口:系統提供API接口申報數據。具體要求見“數據接口說明”欄目。
4、發碼機構
發碼機構需登錄系統,填寫基本信息并提交。相關基本信息將在“發碼機構及規則”欄目中對外發布。
詳細操作步驟請下載《國家藥品監督管理局醫療器械唯一標識管理信息系統用戶手冊V1.0》。
>>>數據申報說明
為方便醫療器械注冊人/備案人等相關方了解唯一標識管理信息系統相關字段內容、要求、注意事項,特制定醫療器械唯一標識填報說明。
詳細內容請下載《國家藥品監督管理局醫療器械唯一標識管理信息系統數據填報說明V2版》-20200617。
>>>數據對接說明
適用于醫療器械注冊人/備案人(注冊人/備案人委托的第三方機構)等申報方通過接口對接數據,適用于流通機構、醫療機構等數據共享方等通過接口獲取數據。以上相關方應仔細閱讀以下文檔,以幫助開展相關對接工作。
接入概述
接入醫療器械唯一標識數據庫,相關方需要按照以下步驟完成:
第一步,下載《國家藥品監督管理局醫療器械唯一標識數據庫對接申請表V1.0》,打印并填寫完整,加蓋企業公章。
第二步,點擊對接注冊申請菜單,進入機構基本信息填寫界面,填寫機構基本信息(標注*為必填項),上傳對接申請表(必須為已填寫完整并加蓋企業公章的pdf文件)。上傳完成后,提交后等待審核。在審核通過后,本次對接申請的接口授權信息將會以郵件的形式發送到您的郵箱。
第三步,依據接口標準文檔實現業務邏輯。
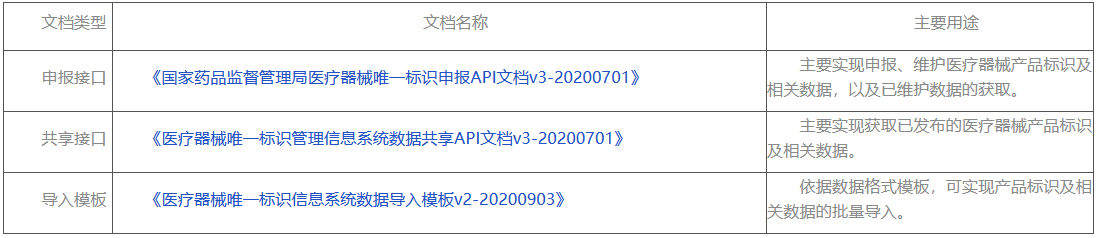
第四步,完成業務系統的改造集成后,可先通過調用測試環境請求地址(詳見API接口文檔)進行業務邏輯與數據的驗證。
第五步,數據核驗通過后且確認無誤后,可自行切換至正式環境請求地址(詳見API接口文檔),實現產品標識及相關數據的申報、下載。
注意
若醫療器械注冊人/備案人想通過第三方業務平臺實現產品標識及相關數據的申報,可登陸醫療器械唯一標識管理信息系統通過產品申報委托授權功能,選擇已獲得授權的第三方機構,進行關系授權操作,授權關系建立以后,第三方業務平臺才能有權限進行數據同步傳輸。
對于自行實現業務系統集成對接的醫療器械注冊人/備案人可忽略此功能。
有關說明
為了識別注冊人/備案人、注冊人/備案人委托的第三方機構、流通機構、醫療機構等數據對接方,系統會為每一個對接申請者生成一個獨立的appId,用于確認辨別對接方的身份以及接口權限。
1、在開發過程中,可以使用接口調試工具(如:POSTMAN)來調試某些接口。
2、每個接口都有每日接口調用頻次限制,可以在接口詳細文檔中查看具體頻次。
3、在開發出現問題時,可以通過接口調用的返回狀態碼,以及錯誤內容描述,發現和解決問題。
4、對接方以access_token為接口調用憑據,來調用接口,所有接口的調用需要先獲取access_token,access_token在當天內有效,過期需要重新獲取,但1天(自然日)內獲取次數有限,開發者需自行存儲,詳見接口文檔中的獲取接口調用憑據(access_token)相關內容。
5、醫療器械唯一標識管理信息系統測試環境:https://udid.nmpa.gov.cn/beta/login.html;測試環境登錄賬號與正式環境賬號相同。



