目前UDI正不斷推進落實中,面對一些醫療器械企業還不熟悉UDI的申請、操作流程的情況,作出以下展示:
首先是企業自檢、組建UDI團隊,尋找負責法規注冊的人員實時跟進UDI相關法規發布情況讓企業及時跟上政策作出相應行動;UDI的實行很大程度是利用了當下人工智能大數據的發展,需要有IT信息的相關負責人建立數據庫,以保障數據安全有序錄入調出;此外還需有研發人員進行相關內容的研發,推動企業創新發展,以及生產負責人員,質量監控員、銷售人員、負責把控供應鏈與物流的人員和進行營運管理的人員。有了一個強大的團隊,UDI的實施之路才可能暢通、行穩致遠。如果一時間找不到相關人才也沒關系,可以找高賦碼,進行詢問,提供專業指導。
接著就是選擇適合自家產品的發碼機構,目前市面上手藥監局認證的機構有GS1、MA、AHM三家,在選擇完發碼機構后就需要進行UDI的申報,首先是DI的注冊申請,比較常見的申報流程是在發碼平臺完成注冊繳費得到DI編碼,之后企業根據編碼規則進行編碼和校驗再登錄藥監局平臺填寫產品信息,將DI編碼上報藥監局平臺,藥監局數據庫就會審核所有DI數據并公布申報情況,也可以讓高賦碼協助申請。
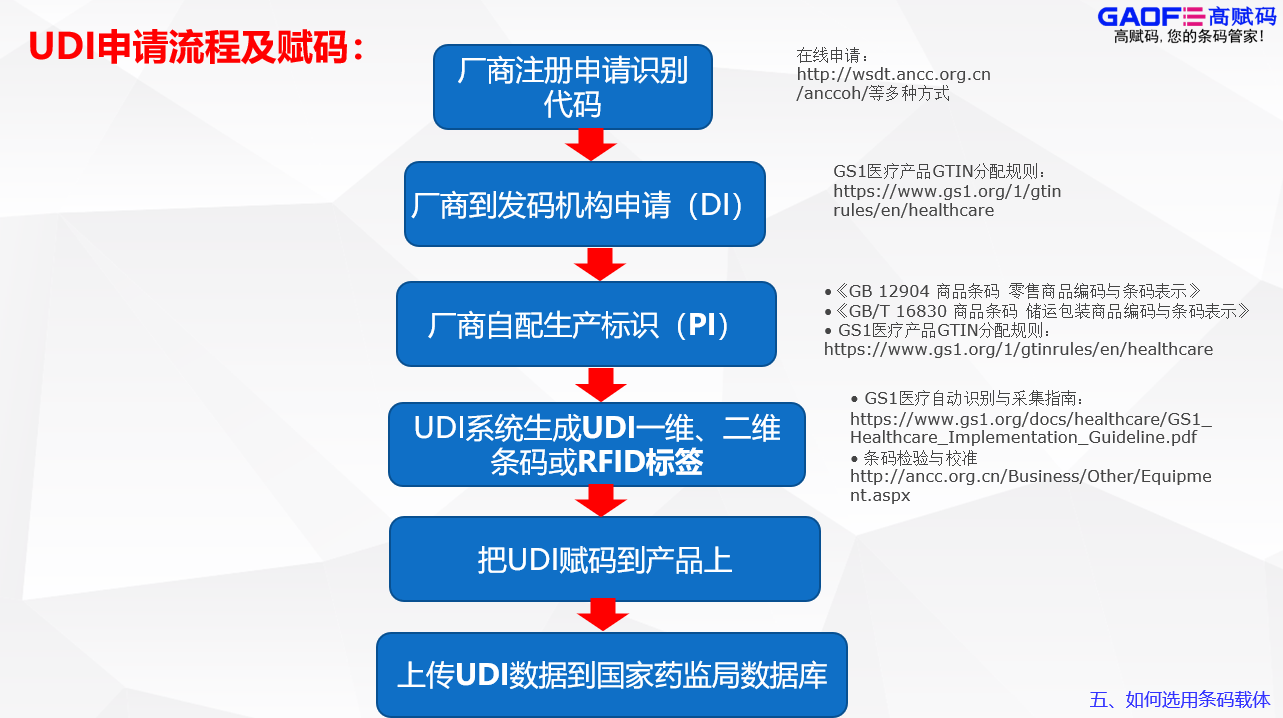
在審核通過后,就要開始進行標簽設計,通過軟件生成相應的數據載體后將其賦碼到產品上,如果使用的是RFID,則必須同時附帶一維碼或二維碼標簽,標簽上除了要有碼圖還要有中文標示說明,標簽的印刷質量需符合ISO15415標準的C級以上,同時UDI的編碼與碼圖內容要保持一致性,一碼一圖,UDI還需符合AIDC與HRI原則。而不同的賦碼設備,其所需要的軟件也不同,操作模式也不相同。



