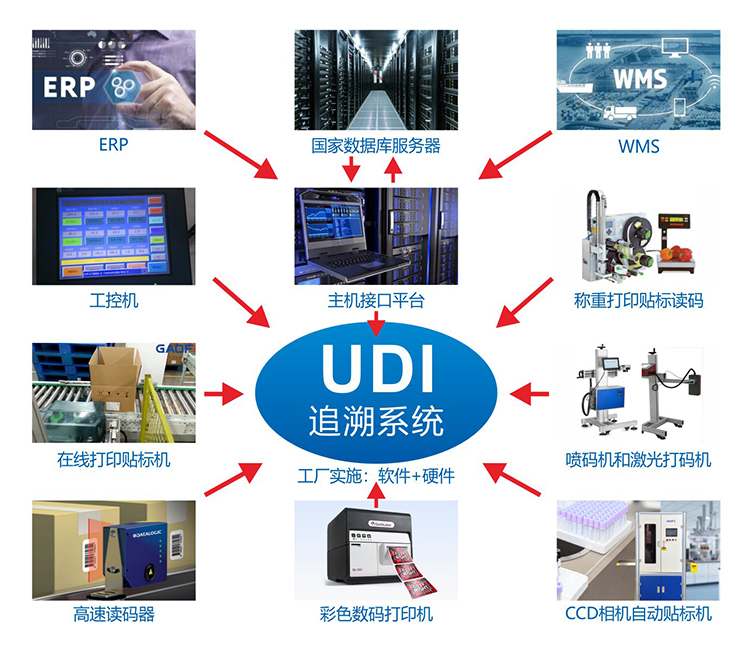
《中國食品藥品網(wǎng)訊(記者滿雪)9月17日,國家藥監(jiān)局、國家衛(wèi)生健康委、國家醫(yī)保局聯(lián)合發(fā)布《關(guān)于做好第二批實(shí)施醫(yī)療器械唯一標(biāo)識(shí)工作的公告》(以下簡稱《公告》)。《公告》明確,在第一批實(shí)施醫(yī)療器械唯一標(biāo)識(shí)的9大類69個(gè)品種基礎(chǔ)上,將其余第三類醫(yī)療器械(含體外診斷試劑)納入第二批實(shí)施唯一標(biāo)識(shí)范圍。2022年6月1日起,生產(chǎn)的第二批實(shí)施品種應(yīng)當(dāng)具有醫(yī)療器械唯一標(biāo)識(shí)。
今年1月1日起,首批9大類69個(gè)醫(yī)療器械品種實(shí)施唯一標(biāo)識(shí)。此次,三部門再次聯(lián)合發(fā)文,在首批品種基礎(chǔ)上,將其余第三類醫(yī)療器械(含體外診斷試劑)納入第二批實(shí)施唯一標(biāo)識(shí)范圍。同時(shí),支持和鼓勵(lì)其他醫(yī)療器械品種實(shí)施唯一標(biāo)識(shí)。
公告》明確了納入第二批實(shí)施唯一標(biāo)識(shí)的醫(yī)療器械注冊人的相關(guān)工作實(shí)施時(shí)間。對于唯一標(biāo)識(shí)賦碼,2022年6月1日起,生產(chǎn)的醫(yī)療器械應(yīng)當(dāng)具有醫(yī)療器械唯一標(biāo)識(shí);此前已生產(chǎn)的第二批實(shí)施唯一標(biāo)識(shí)的產(chǎn)品可不具有唯一標(biāo)識(shí)。在唯一標(biāo)識(shí)注冊系統(tǒng)中,2022年6月1日起,申請首次注冊、延續(xù)注冊或者注冊變更時(shí),注冊申請人/注冊人應(yīng)當(dāng)在注冊管理系統(tǒng)中提交其最小銷售單元的產(chǎn)品標(biāo)識(shí)。
需要注意的是,2022年6月1日起生產(chǎn)的醫(yī)療器械,在其上市銷售前,注冊人應(yīng)當(dāng)按照相關(guān)標(biāo)準(zhǔn)或者規(guī)范要求將最小銷售單元、更高級別包裝的產(chǎn)品標(biāo)識(shí)和相關(guān)數(shù)據(jù)上傳至醫(yī)療器械唯一標(biāo)識(shí)數(shù)據(jù)庫,確保數(shù)據(jù)真實(shí)、準(zhǔn)確、完整、可追溯。當(dāng)醫(yī)療器械最小銷售單元產(chǎn)品標(biāo)識(shí)相關(guān)數(shù)據(jù)發(fā)生變化時(shí),注冊人應(yīng)當(dāng)在產(chǎn)品上市銷售前,在醫(yī)療器械唯一標(biāo)識(shí)數(shù)據(jù)庫中進(jìn)行變更,實(shí)現(xiàn)數(shù)據(jù)更新。
《公告》提出對醫(yī)療器械注冊人、醫(yī)療器械經(jīng)營企業(yè)、醫(yī)療機(jī)構(gòu)、發(fā)碼機(jī)構(gòu)的要求,同時(shí)強(qiáng)調(diào)省級藥監(jiān)部門、衛(wèi)生健康部門、醫(yī)保部門要加強(qiáng)指導(dǎo)規(guī)范,做好第二批醫(yī)療器械唯一標(biāo)識(shí)實(shí)施工作。
唯一標(biāo)識(shí)可有效提升醫(yī)療器械全生命周期精準(zhǔn)化管理水平,實(shí)施品種的進(jìn)一步擴(kuò)大將深入推進(jìn)醫(yī)療器械唯一標(biāo)識(shí)制度落地實(shí)施,對實(shí)現(xiàn)唯一標(biāo)識(shí)在“三醫(yī)聯(lián)動(dòng)”中的拓展應(yīng)用具有重要意義。